Den
europæiske kemi i det 20. århundrede. mere
europæisk kemihistorie før 1900 Herunder
glasvarer opkaldt efter berømte
kemikere.
 fig.
1 f g. 2
fig.
1 f g. 2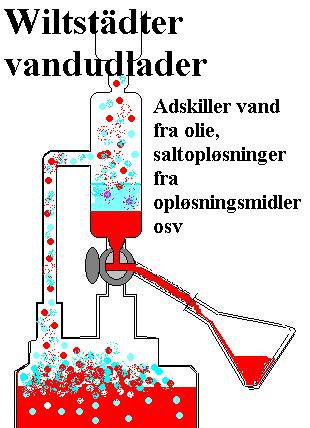
En (radio-) historie om ammoniak:
andre gasarter kul-gas gasværket krigsgasNår kvælstofholdige organiske stoffer rådner frigives ammoniak, som det kendes fra gyllebeholderen hos landmanden, og lugten herfra kan være temmelig overvældende og generende. Når landmanden spreder gyllen, altså dyrenes urin, ud på marken, optages kvælstofatomet fra ammoniakmolekylet ved hjælp af salpeterbakterier til nitrat, der kan optages af planterne som næring. Ammoniakken fungerer i et samspil med syrerne i jorden som næring til planterne, mens dog bælgplanterne selv kan udvinde kvælstof fra luften, fordi de jo er i besiddelse af specielle bakterier på rødderne; Kvælstofbakterier der kan hjælpe dem til at skaffe næringen frem i brugbar form. Bælgplanter er i øvrigt planter som ærter og bønner. Ammoniak er en gasart også kaldet salmiakspiritus når den er opløst i vand, med typisk 25 % (3-dobbelt, dvs.1150 ltr.NH3 gas/ltr.vand) eller hos metallurgen i form af en 8% opløsning af luftarten (retteligen burde 3-dobbelt vel så være 24%!). Luftarten, der består af et kvælstofatom sat sammen med 3 brintatomer, har en skrækkelig stikkende lugt. Ammoniak er giftig og mange ofte dødelige ulykker er gennem tiderne sket ved, at personer er faldet i en, som det var i tidligere tid, ofte dårligt sikret gylletank og ofte er ulykken yderligere blevet værre af, at tililende har forsøgt redning ved at gå ned i tanken uden sikring og så her også er besvimet og endt som yderligere ofre. Redning kræver åndedrætsværn med lufttilførsel og beskyttelsesdragt samt iltanlæg til genoplivning mv!
Man bruger bl.a. luftarten til kølemedie i større køleanlæg (eller gammeldags køleskabe, der for sidstnævntes vedkommende dog ikke kan konkurrere med nutidens "lav-energiskabe"). I Københavns "hvide Kødby" (ved Dybbølsbro Station på Vesterbro) findes et større anlæg med 16 tons ammoniak, der fordeles rundt til brugerne af kølemidlet, der så lokalt bruges til, ved sin ekspansion, at afkøle virksomhedernes kølerum. I anlægget kan luftarten igen uden stort besvær bringes på væskeform (ved sammenpresning). Anlægget er bygget i 1930'erne og er renoveret i 1990'erne og der er nu af miljøkontrollen pålagt indretningen af en overbrusningsanordning som sikringsforanstaltning i tilfælde af udslip. Lagertanken, der kun er delvis fyldt, rummer 3 tons, hvilket ville kunne skabe alvorlige problemer for beboere på det halve Vesterbro udover (hoved-) jernbanelinien og øvrige virksomheder, skoler osv. i nærheden.
Luftarten i væskeform kan direkte
nedfældes i jorden som gødning (stakkels regnorme!), i stedet for "gylle"
(dyrenes urin), der bl.a. er ammoniak i opløsning og som udspredes på marken (til
almindelig lugtgene for de nærmeste beboere).
Så lidt som 0,05 g af stoffet pr. kubikmeter. luft kan lugtes! (grænseværdi
max. 18mg/m3=25ppm)
I gamle dage fremstilledes ammoniak i retorter, ud fra kvælstofholdige materialer (altså i store destillationsapparater ligesom nævnt ved trædestillation til træsprit, eddike, trætjære og sulfat-beg mv.), senere fås det fra gasværkernes kuldestillation, hvor stenkul på lignende måde befries for sine flygtige bestanddele og bliver omdannet til "cokes" (heraf ordet koks). Gassen renses for netop ammoniak, men også cyangas og andre urenheder i gassen, der efter rensningen blir til den såk. "bygas". Cyangassen frarenses som såk. gasrensemasse, der består af myremalm også kaldet okker altså naturligt jernoxid, der bliver omdannet til "berlinerblåt" (det kaldes også miloriblå pigment og kemikerne kalder det ferroferricyanid) og ammoniakken renses bagefter fra under gennembobling gennem vaskevand, således at vandet optager luftarten til nævnte ammoniakvand. Berlinerblåt er et almindeligt malerfarvepigment, der trods cyanid-indholdet heri, ikke er udpræget giftigt, men dog udgør et miljøproblem på gamle gasværksgrunde, hvor cyanid kan frigøres og sive til grundvand udover andre problemer hidrørende fra gasrensningen (fx. tjære).
Ammoniakvandet destilleres med kalk og neutraliseres med svovlsyre til ammoniumsulfat, et vigtigt stof i kunstgødningsfabrikationen. Opvarmes ammoniumsulfat med kridt fås "hjortetaksalt", der er et almindeligt bagepulver, men fx. også anvendt af metalkemikeren og her kaldt ammoniumkarbonat.Justus Liebigs laboratorium
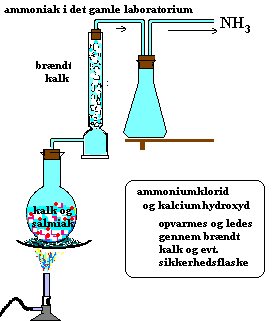

Man kan til fremstillingen også anvende tørv, urin, slam o. lign., ligesom man ved tør-destillationen af træ i retorterne til træsprit og trækul finder det som et af biprodukterne. Størst betydning for fremstilling netop af ammoniak, har "Haber-Bosch metoden" fået. En metode hvor luftens kvælstof omdannes med brint v.hj.a. højt tryk og katalysatorer, som metode også kaldet "Habers-Serpeks". Fritz Habers navn går igen og han fik jo Nobelprisen for opfindelsen, der førte ham videre mod krigskemiens uhyggelige videnskab, hvorfor man så følgende har givet ham tilnavnet "Gaskrigens opfinder".


Mindst 2 andre metoder udover de her nævnte har været anvendt gennem tiden Fx. "Frank-Caros" udfra cyanider og "Serpeks" hvor nitrider sønderdeles.
Fritz Haber (TV.)
Haber-Bosch metoden: Kvælstof og brint laves til ammoniak (v.hj.af tryk og katalysator)
N2+3H ↔ 2NH3 + varme (der anvendes jern/ kaliumaluminat som katalysator ved 2-300 atm. tryk)
NH3 kan med ilt (og katalysator) omdannes til HNO3 (salpetersyre), der ved blanding med NH3 giver ammoniumnitrat (=både kunstgødning og sprængstof).
Salte af gasarten dannes som fine såkaldte "salpeterblomster" på staldvæggene som følge af ammoniak-afgasningen fra dyrenes gylle.
Som nævnt bruger metalkemikeren den vandige opløsning idet han hermed kan frigøre metallerne fra syren, så metal(hyd)oxydet bundfælder, men han skal her huske at guld og sølv kan blive explosionsfarlige på denne måde i form af "knaldguld" og "-sølv", mens bly-hydroxyd fx. uden fare kan fældes ud fra blyacetatopløsning (eller -nitratopl.), der dog er temmelig giftigt, hvis det indtages fra arbejdsmiljøet. I gamle dage kaldtes blyacetat for blysukker, og det blev endog anvendt til sødestof (og i øvrigt konserveringsstof) i sur vin (tak skæbne!). Bundfaldet glødes til blyoxyd, som vi måske kender under navn af blymønje i rustbeskyttelsesmalinger el. såk. mønjemalinger.
Mineralogien og ammoniak:
Salpetersurt Uran fra malm eller atomaffald ( dvs. urannitratopløsning) kan
bundfældes med et (tidl. nævnt) salt nemlig hjortetakssalt dvs.
ammoniumkarbonat altså en forbindelse af ammoniak og kulsyre. Sidste navn
populært sagt sammensat af ordene "salt af ammoniak og karboxylsyre",
men som det gamle navn antyder blev det faktisk i rigtig gamle dage fremstillet
ved destillation af hjortetakker (igen ligesom trædestillationen mv.) Efter
tilsætningen af ammoniumkarbonat til uransuppen, iltes opløsningen med
brintoverilte (som vi kender brugt til sårbehandling, oftest så i 3%
opløsning, Formelen på det er H
Jern bundfælder bedst i en endnu stærkere base end ammoniak eller med cyanid (såk. blåsyre eller dets kalisalt cyankalium, der kan opløse guld og som enhver vel kender) Cyanid fælder også zink, hvilket ammoniak ikke gør. Metallet zink medriver ofte sølv mv. under oxiddannelsen så sølv kan udvindes herfra ved at tilsætte kold, ca.10% saltsyre, hvorved sølv samt evt. tilstedeværende bly og den stærke gift thallium udfælder som klorider, hvorfra thallium fx. fjernes ved vask med varmt vand ad flere gange. Guld opløst i kongevand (dvs. saltsyre med lidt salpetersyre) udfældes herfra med zink-afklip, der i øvrigt farver uranopløsninger grønne.
Alt dette bruger den uorganiske kemiker og mange andre som værktøj både til analyse, produktion og recirkulation. Prospektoren analyserer mineraler og salte. Fabrikken producerer kærnebrændsel og rene metaller, mens skrot i form af biler, elektronik, batterier osv. genbruges efter adskillelse og oparbejdning, hvorved skrotvirksomheden bliver en ny type "guldgruppe" eller (evt. samfundsnyttige) minedrift.
Den organiske kemi og den industrielle produktion.
Efter den 2. verdenskrig blev Vesttyskland storproducent
af kunstige fibre og tekstiler, men dette var fortsættelsen på en epoke i
europæisk kemi, den tyske, fra Hoffmann til
Haber.
Et uhyggeligt exempel på den organiske kemi er indenfor våbenproduktionen,
hvor udviklingen efter Fritz Haber, der er den kemiske krigsførelses
"far", fører mod avancerede organiske stoffer til uskadeliggørelse
af fjenden. Fritz Haber fik i øvrigt Nobelprisen for sin metode til
ammoniaksyntese (Haber-Bosch metoden), men skabte også den tyske kemiske
krigsvåben med våben som Klor-, fosgen-, cyangas osv. og deltog ivrigt i
afprøvningen ved fronten i 1. verdenskrig, hvor en vis tapetsererlærling blev
udsat for den ubehagelige virkning af disse nye våben, som Haber ikke mente var
et brud med krigskonventionernes forbud mod giftige og sygdomsfremkaldende
stoffer. Om cyanidgassen sagde han: Man kunne ikke dø på en mere komfortabel
måde... Hans kone begik selvmord i græmmelse over mandens fascination af det
kemiske "gas-våben". Haber var faktisk uorganisk kemiker, der også
interesserede sig for fx. meteorologi, der jo også er af stor betydning
ved anvendelsen af de kemiske kampstoffer og "krigsgasserne".
Fra Den 2. verdenskrig.......
Uddrag af The American Hebrew, 4. december 1942:
"Kroppene bruges i specialfabrikker til fremstilling af sæbe, lim og
smøreolie til tog"...."Det er endvidere konstateret, at nazistiske
medicinere siden 1932 har eksperimenteret med videnskabelige metoder til
udryddelse og udnyttelse af menneskekroppe. Værdien af et menneskelegeme er nu
anslået til 50 Reichmark".
Det hævdes i bladet at togstammer med døde kroppe siden august (altså 1942)
er ankommet til den tyske grænse og at en ny aflivningsmetode er taget i
anvendelse i stedet for gaskamrene nemlig indsprøjtning af luft i venerne.
find jern-
og blykemi (ovenover) Iron/lead (above)
Glasvarerne udvikler sig: Umiddelbart herover ses retorten, der udvikles til
forskellige koge- og standkolber (som fig.1).
Wiltstädter (fig.2) samarbejdede
med Haber (fig.3).
top igen
Råstofferne til den uorganiske kemi Geologi, geokemi, mineralogi, analysen mv. brint,hydrogen andre luftarter
